人们已经建立了多种干预方法来控制食品中的腐败或致病菌,例如高静水压、电解氧化水、超声波、辐射、某些化学品或精油。高静水压(HHP)是一种非热食品灭菌和保鲜技术,可以在不损害产品感官质量的情况下减少微生物。在典型的 HHP 程序中,食品被密封并放入装有压力传输介质的钢室中,并使用泵来产生压力。HHP对食品灭菌和保鲜的效果会受到处理压力、处理时间和传压介质的影响传统上,HHP多采用普通水作为传压介质,但也有研究表明,改变传压流体可能会改善HHP的传压介质。HHP 的灭活作用。

近年来,次氯酸/酸性电解水(AEW)被认为是一种有效的消毒剂,并广泛应用于许多国家的食品行业。通过在特定装置中电解,稀释的氯化钠溶液解离成 AEW,其 pH 值较低,为 2-3,氧化还原电位 (ORP) > 1100 mV,活性氯含量 (ACC) 为 10 –90 ppm。与传统消毒剂相比,AEW不仅具有更好的杀菌效果,而且对公众健康和环境的不利影响较小。前期研究证明AEW与其他干预方法相结合可以显着提高其灭活效率。然而,目前还没有研究报道AEW可以作为HHP的新传输介质。此外,AEW 对 HHP 灭活效率的影响尚不清楚。
本研究首次开发了一种利用HHP结合AEW作为新型传输介质的新型灭菌保鲜技术(AEW-HHP)。应用响应面 (RS) 模型来量化 AEW 对高静水压加工的影响,以减少带壳鲜虾的致病菌。并通过去壳鲜虾原生菌群的减少和肌纤维的变化来评价新技术的保鲜效果。这种新颖的灭菌保鲜技术可以为消除病原微生物、提高海产品质量和安全提供有力的工具。

菌株和培养物制备
副溶血性弧菌菌株(ATCC 17802;ATCC 33847;F 18,凡纳滨对虾分离株;F 36,血清型 O3:K6)的四菌株混合物和单核细胞增生利斯特氏菌(ATCC 19115;ATCC 19116)的两菌株混合物研究中使用。将副溶血弧菌的每种菌株(-80°C 储存于 25% 甘油中)分别在胰蛋白酶大豆肉汤加 3% NaCl 中培养,并在 37°C 下孵育18小时。单核细胞增生利斯特氏菌的其他菌株在 37°C 的 TSB 中生长 18-20 小时。将富集的培养物汇集到无菌离心管中,并在 3000 g、25°C 下离心 10 分钟。将沉淀的细胞重悬于无菌蛋白胨水(PW;0.85% 氯化钠,0.1% 蛋白胨)中,以获得副溶血弧菌和单核细胞增生李斯特菌分别约为 9 log 10 CFU/ mL的多菌株混合物。
虾样品的制备和接种
每次实验前,从海鲜市场购买活的新鲜虾(凡纳滨对虾),并装在塑料袋中运送到实验室,塑料袋中装有充有氧气的池塘水,以保持虾的活力。在实验室,按照GB/T 4789.7-2008(中国国家标准规范,2008)中描述的方案,用自来水冲洗虾。将虾斩首、去皮并在紫外线下消毒30分钟。将去壳鲜虾样品(每只虾 7 ± 1 g)浸泡在 200 mL 含有四种副溶血性弧菌菌株(或两种单核细胞增生李斯特氏菌)的悬浮液中。菌株)30 分钟,然后转移至塑料板 30 分钟以允许细菌附着。上述方案在室温(23±2°C)下进行。接种后的虾用于后续处理。
酸性电解水(AEW)的制备
使用AEW发生器通过电解不同浓度的氯化钠(电解的氯化钠浓度;表1 )来制备具有不同物理化学特性的AEW。在收集水之前,让发生器运行 15 分钟,电流强度设置为 10 A。pH 和 ORP 使用 pH/ORP 计测定。AEW 中的 ACC 使用数字氯测试套件(RC-2Z,Kasahara Chemical Instruments Corp.,Saitama,Japan)通过比色法测定。所有测量均一式三份进行。AEW 的 pH 范围为 2.28–2.39,ORP 1077–1168 mV,ACC 36–73 mg/L。
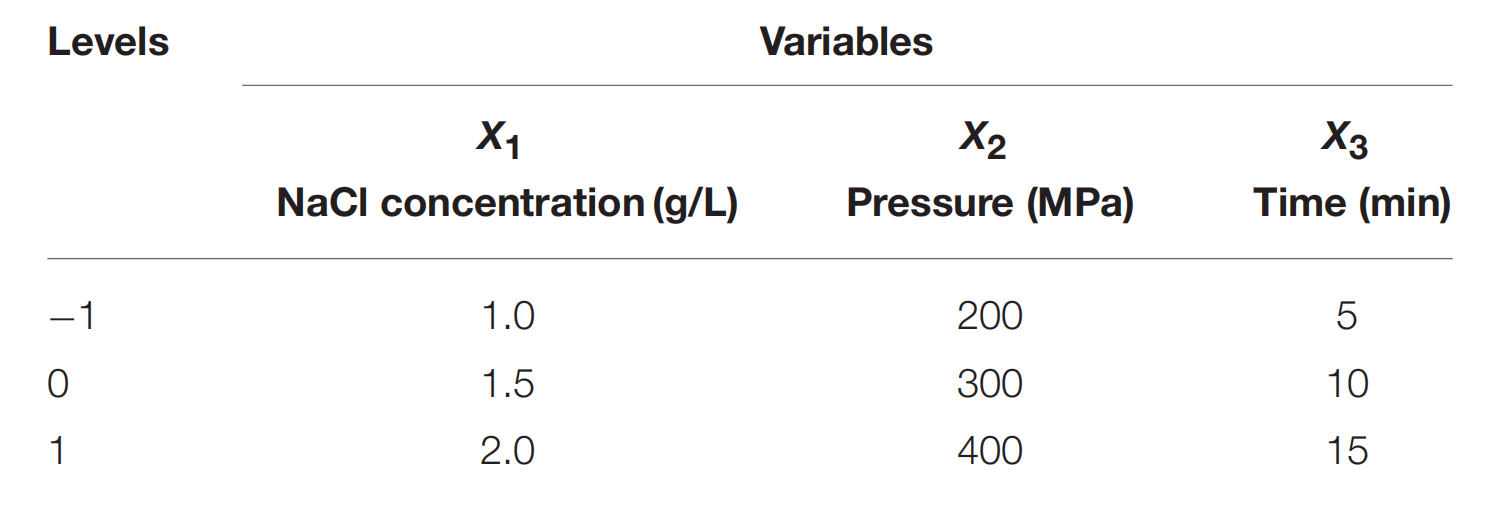
表1 BOX-BEHNKEN 实验设计所用变量的代码和级别
高静水压 (HHP) 治疗
本研究使用高压食品加工机。上升速率约为 240 MPa/min,压力释放时间几乎是立即的。将样品包装在无菌塑料袋中,并在所需水平 200、300 或 400 MPa 下进行处理,处理时间为 5、10 或 15 分钟。HHP采用普通水或AEW作为传输介质。
细菌计数
本研究采用的细菌计数方法是根据既往研究的平板计数法。简而言之,将虾样品在胃搅拌器(BagMixer)中均质化 2 分钟。然后,使用直接平板法对虾样品上的副溶血性弧菌、单核细胞增生利斯特氏菌和本土微生物群落进行计数。TCBS 琼脂用于副溶血弧菌,PALCAM 琼脂用于单增李斯特菌分别使用胰蛋白酶大豆琼脂作为本土微生物群。直接平板法的检测限约为 2 log 10 CFU/g。将平板在 37°C 孵育 24 小时后进行菌落计数。每个采样时间进行三次重复。
响应面模型开发和验证
基于 Box-Behnken 实验设计 (BBD) 的 RS 方法用于描述副溶血性弧菌灭活的三个技术变量之间的关系和相互作用(表1 ) 。使用 Design Expert 软件包(版本 8.0.6,Stat-Ease Inc.)设计处理条件(表2),进行回归分析并生成二阶多项式模型。虾样品在不同条件下进行处理(表2),响应值表示为处理后的Log 减少量。
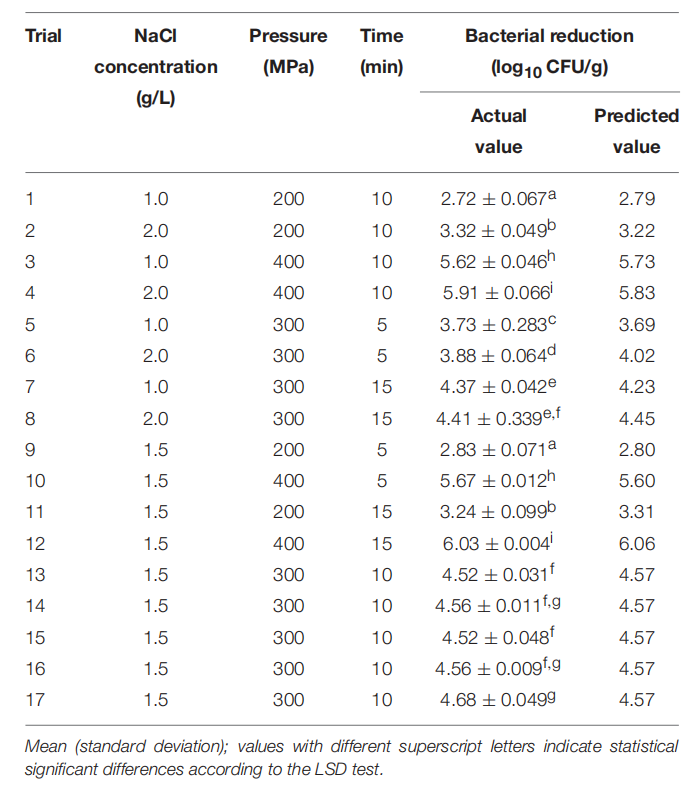
表2 根据 BOX-BEHNKEN 实验设计安排,通过响应面模型对虾副溶血弧菌的实际和预测减少量。
进行方差分析 ( ANOVA ) 和相应的事后对比,以比较不同实验条件的结果。使用确定系数(R 2)、Fisher F检验和失拟检验的P值来评估模型的统计显着性和拟合优度。描述副溶血性弧菌灭活的 RS 模型的准确性通过以下标准进行评估:准确性因子(Af,方程 1)、偏差因子(Bf,方程 2)和均方根误差(RMSE,方程 1) 3
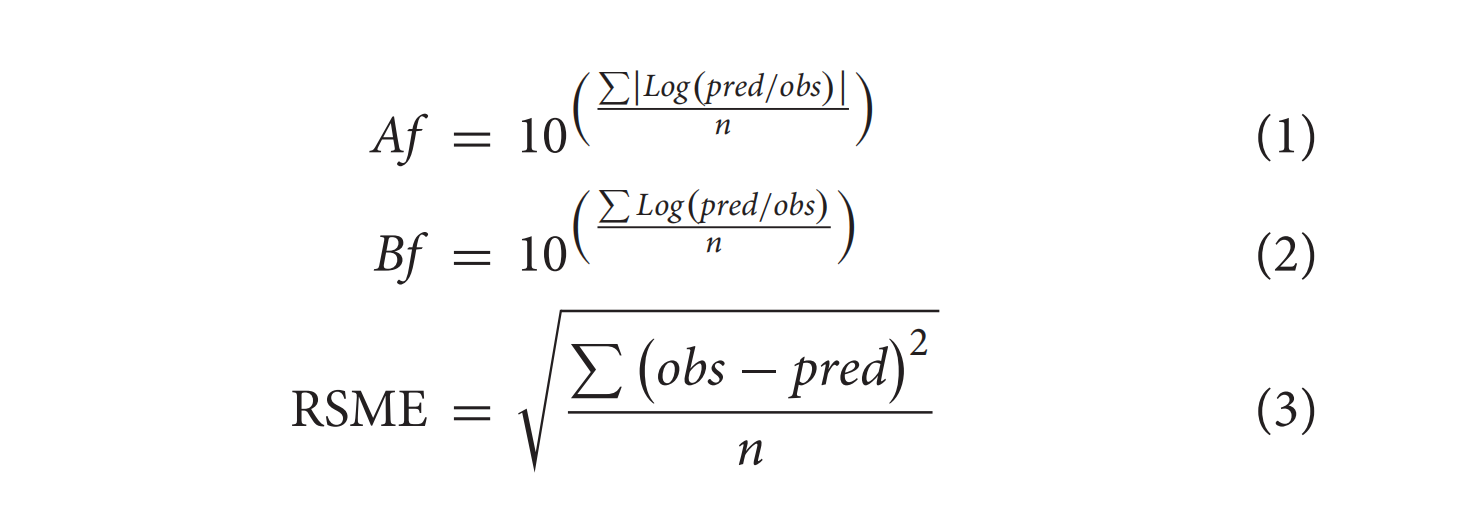
其中obs为观测值,pred为RS模型预测值,n代表观测值的数量。理想情况下,预测模型应具有Af = Bf = 1。响应曲面图和等高线图用于描述变量的个体效应和相互作用。
为了验证该模型,我们进行了八项随机组合四个变量的额外试验(表3)。对虾的细菌灭活方法与之前所解释的灭活处理相同。所选参数在实验设计的原始范围内,但未纳入模型的建立。观察到的结果用于通过Ross (1996)提出的Af(公式 1)和Bf (公式 2)来评估模型的性能。
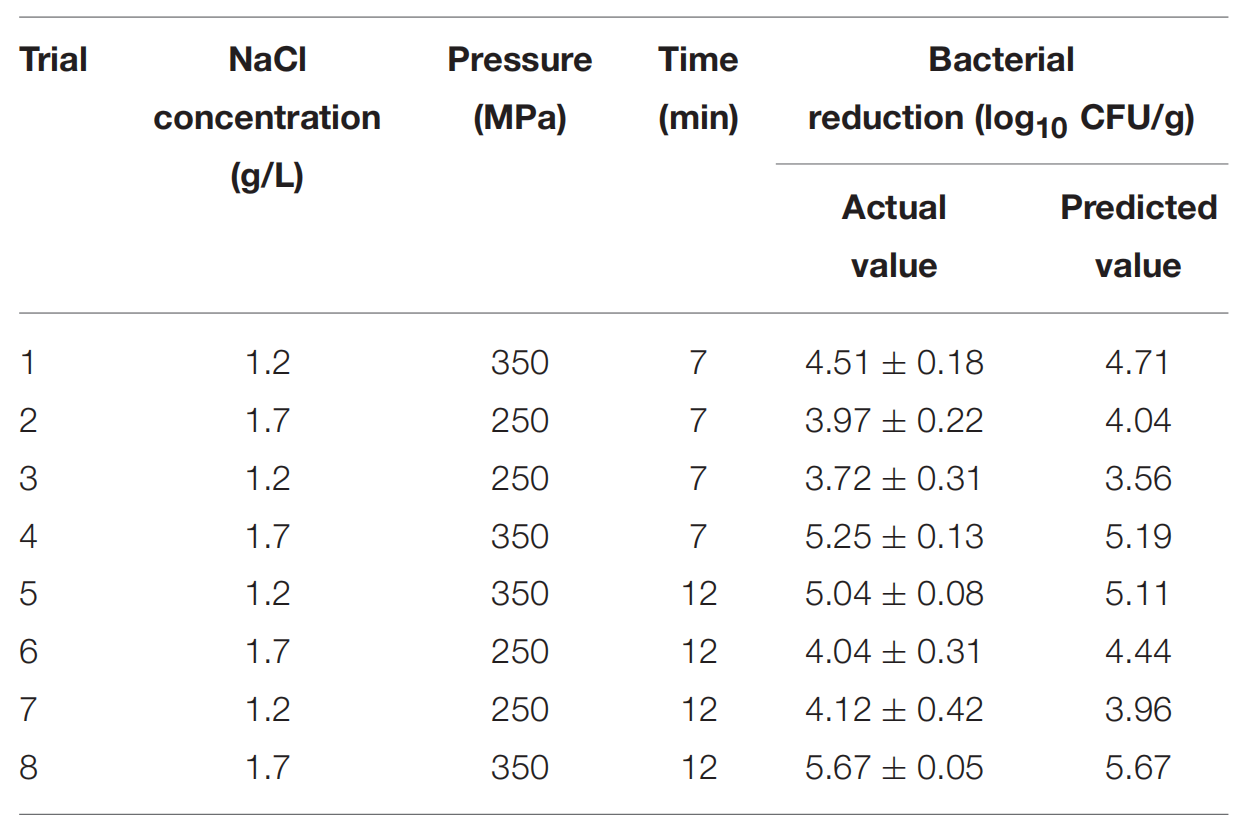
表3 在额外的随机八个条件下,带壳鲜虾副溶血弧菌灭活的实际和预测减少值。
AEW-HHP处理在人工污染带壳鲜虾上的应用
通过RS方法获得了AEW-HHP对人工污染虾细菌灭活的最佳条件。根据最佳条件,对人工污染的副溶血性弧菌或单核细胞增生利斯特氏菌污染的带壳鲜虾样品进行AEW-HHP处理。处理条件设定为电解氯化钠浓度1.5 g/L,处理时间10 min,处理压力200、300、400 MPa。如上所述通过平板接种测定细菌减少。
扫描电子显微镜 (SEM) 观察
经过AEW-HHP处理后,通过SEM观察人工污染的带壳鲜虾上的细菌。样品的制备和观察均按常规方法进行。简而言之,将处理后的人工污染虾样品用2.5%戊二醛固定,然后在分级乙醇系列中脱水,涂上金钯(离子溅射和碳涂层装置E-1045)并在扫描电子下观察显微镜。
AEW-HHP处理在自然污染带壳鲜虾上的应用
为了进一步验证灭活效果,应用AEW-HHP处理来消除自然去壳鲜虾上的本土微生物群落。处理条件设定为电解氯化钠浓度1.5 g/L,处理时间10 min,处理压力200、300、400 MPa。使用 TSA 对本地微生物区系进行细菌计数。采用PCR-DGGE分析对虾的细菌多样性,并通过组织学分析评价对虾的品质。
使用 PCR-DGGE 进行细菌多样性分析
PCR-DGGE 分析用于评估自然污染虾上细菌多样性的变化。根据Ampe等人描述的方法提取DNA。简而言之,所有样品在胃中均质化 2 分钟。将所得悬浮液(1mL)离心(12,000g,2分钟),然后弃去上清液。使用DNA提取试剂盒(TIANamp细菌DNA试剂盒)提取获得的沉淀物的DNA。一微升 DNA 样本用作 PCR 模板。引物 V3-2 (5'-ATTACCGCGGCTGCTGG-3') 和 V3-3 包含一个 40 bp GC 夹 (5'-CGCCCGCCGCGCGCGGCGGGCG GGGCGGGGGCACGGGGGGCCTACGGGAGGCAGCAG-3'),用于扩增 16S rDNA 的高变 V3 区。就长度和种间异质性而言,V3 区域是一个不错的选择。PCR 混合物由 25 μL Premix Ex Taq 、19 μL ddH 2 O、1 μL 每种引物和 2 μL DNA 模板组成。反应在热循环仪(Mastercycler pro S)上进行。PCR 程序根据Muyzer 等人进行。稍作修改如下:95°C 初始变性 3 分钟;25个循环,95℃变性1分钟,55℃退火1分钟,72℃延伸30秒;最后在 72°C 下延伸 5 分钟。扩增产物用 1% (m/v) 琼脂糖凝胶电泳分离,并在紫外灯下可视化。
使用 BioRad DCode™ 通用突变检测系统使用 20 μL 纯化并浓缩的 PCR 产物进行 DGGE。将 PCR 产物涂在含有 40-55% 尿素甲酰胺变性梯度的 1 × TAE 缓冲液中的 8% (m/v) 聚丙烯酰胺凝胶上。恒温(60℃)100V电泳10h。DGGE 凝胶用 SYBR green I 染色并在紫外光下可视化。所有测定均一式两份进行。
使用 Image Lab分析 DGGE 凝胶的扫描图像。香农指数通过 DGGE 带型分析计算。细菌多样性香农指数H ′由式(4)求得。P i按等式(5)计算。
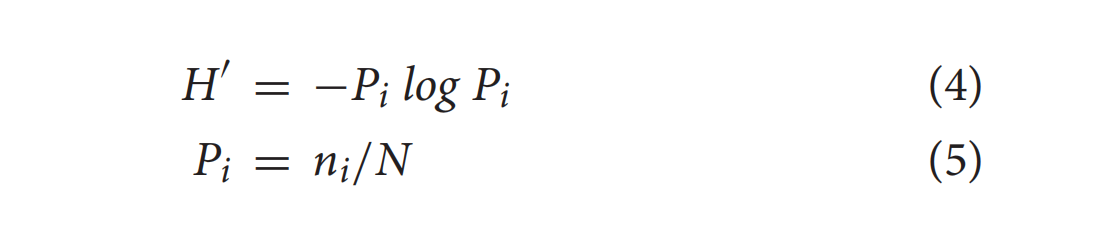
其中P i是凝胶泳道中条带的重要性概率,ni是峰的高度,N是光密度分布中条带的所有峰高度的总和。
组织学分析
根据Liu D.等人的方法进行组织学分析进行了一些修改。切下虾样品的第二个尿节,并在4%福尔马林中固定24小时。将组织用分级系列乙醇(70%、80%、90%、95%和100%)脱水,然后转移到二甲苯中并包埋在石蜡中1-2小时。使用 RM2235 切片机(Leica Microsystems CMS GmbH)获得 7 μm 的组织切片。将切片在水中重塑、干燥、脱蜡、再水合、染色(苏木精-伊红染色)后转移到载玻片上,然后拍照。所有测定均一式三份进行。
根据Díaz-Tenorio 等人的方法对每张图片进行图像分析。空白区域代表肌纤维之间间隙的面积。计算每张图片中空白区域的百分比。结果表示为总分析面积的百分比。
统计分析
所有值均表示为平均值±标准差(SD)。使用SPSS统计软件包17.0(SPSS Inc.)进行统计分析。进行一种方差分析来比较不同条件下的效果。最小显著差异 ( LSD ) 检验用于确定 α = 0.05 时的差异。

AEW-HHP灭活副溶血性弧菌的最佳条件
带壳鲜虾的初始负荷约为 7.1 log 10 CFU/g。BBD 设计了 17 项不同组合条件(电解氯化钠浓度、处理压力和处理时间)下的试验。表2显示了不同条件下带壳鲜虾副溶血弧菌的Log减少结果。Log 减少的实际值范围为 2.72 至 6.03 log 10 CFU/g。
使用Design Expert包进行后向逐步回归,根据表2建立RS模型,建立的模型如下:
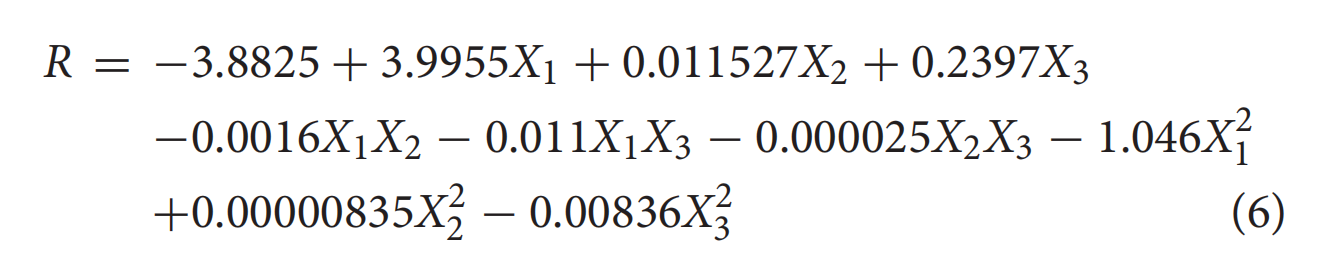
其中R是响应值 (log 10 CFU/g);X 1、X 2和X 3分别代表变量,包括电解的NaCl浓度、处理压力和处理时间。二次模型的方差分析结果表明回归方程的拟合优度:R 2和Adj。R 2分别为0.994和0.986。Adj.R 2的值表明观测值和预测值之间存在高度相关性,这表明当前模型只能解释总变异的 1.6%。RMSE 还提供了模型与用于生成模型的数据的拟合优度的度量,其值为 0.29,表明 RS 模型与观测数据拟合良好。使用 Fisher F检验和失拟检验确定模型的统计显著性和充分性(表4)。F值 129.49 和概率值 ( p< 0.0001)表明不同处理之间的差异非常显著。该模型是足够的,因为失拟检验 ( p > 0.05) 并不显著。
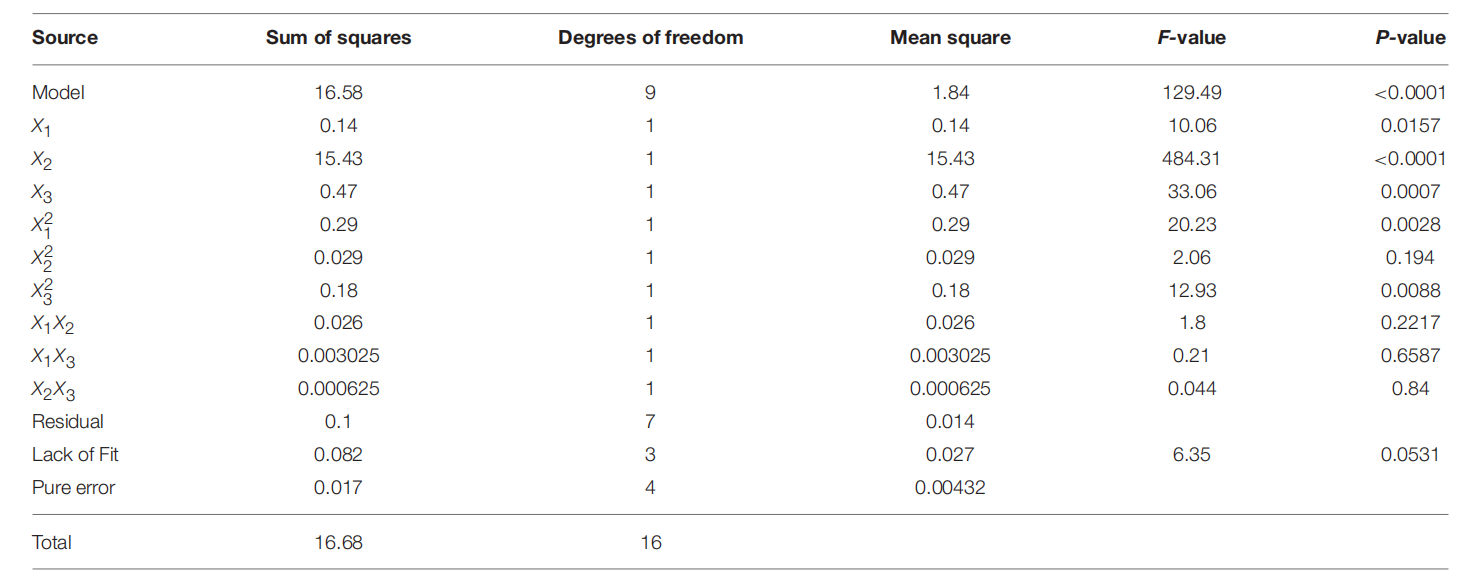
表4 带壳鲜虾副溶血弧菌灭活响应面模型的方差分析 ( ANOVA ) 。
图1A中的响应曲面图描述了处理时间为10分钟时氯化钠浓度和处理压力的灭活效果。随着 NaCl 浓度和压力的增加,带壳鲜虾上的副溶血弧菌数量显著减少 ( p < 0.0001)。氯化钠浓度的变化与处理时间在副溶血性弧菌灭活中起着相似的作用,并且细菌对氯化钠浓度和时间的敏感度低于压力(图1B,C)。估计的最佳处理条件是 1.5 g/L NaCl 浓度,在 400 MPa 下电解 10 分钟,最大细菌减少量为 6.08 log 10 CFU/g。
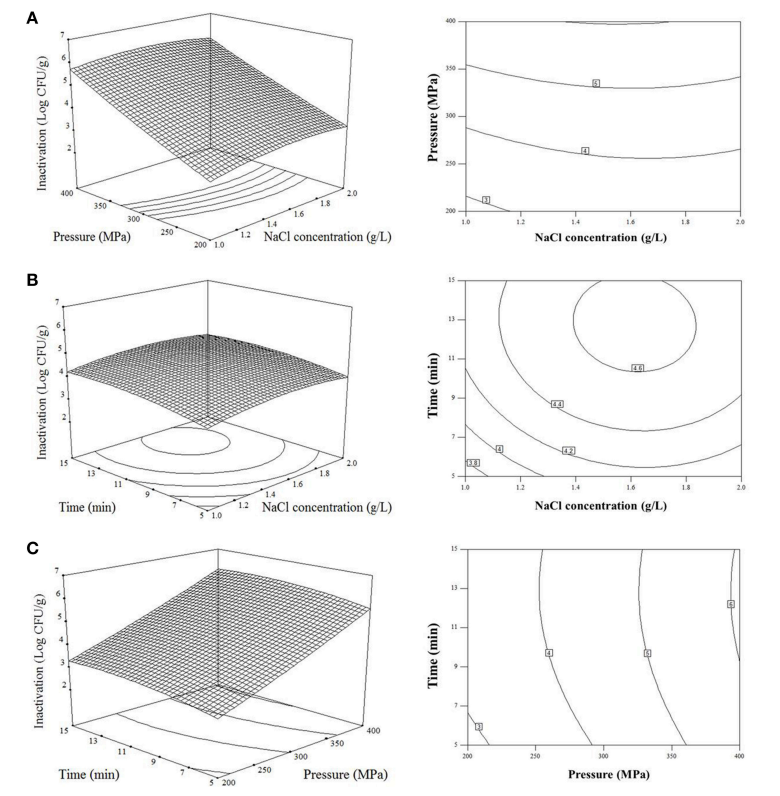
图 1 响应面图描述了高静水压和 AEW 技术变量相结合对虾副溶血弧菌灭活的影响。(A)处理时间10 min时,氯化钠浓度对电解( X 1 )和压力( X 2 )对副溶血弧菌还原的影响;(B) 300 MPa压力下,电解盐浓度( X 1 )和处理时间( X 3 )对还原副溶血弧菌的影响;(C)压力 ( X 2 ) 和处理时间 (X 3 ) 用电解 1.5 g/L 的 NaCl 浓度还原副溶血弧菌。
验证是一个重要的步骤,可以评估已开发模型的能力(Bover-Cid et al., 2012)。因此,进行了外部验证。图2A所示的另外八个独立实验的结果(表3 )用于根据方程(1-3)计算Af、Bf和 RSME。Af值为 1.03,观察结果与预测之间仅存在 3%的差异。计算出的Bf为 1.01,位于Ross提出的 0.9-1.05 可接受范围内。RMSE (0.19) 显示 RS 模型的预测值与观测数据吻合良好。
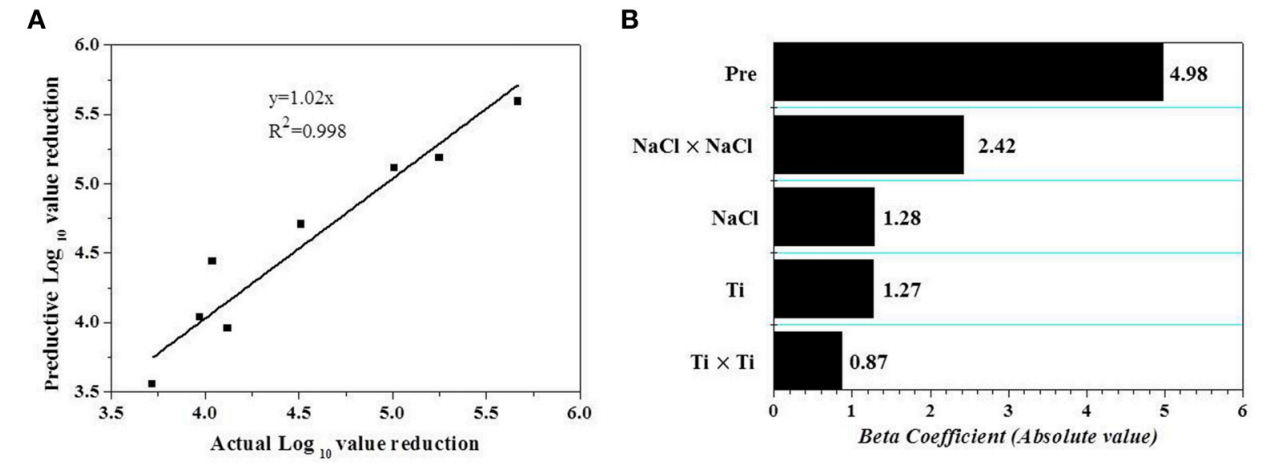 图 2 (A)在实验范围内的额外随机 8 个条件下观察到的虾副溶血弧菌减少量与预测减少量之间的线性相关性。(B)帕累托图,显示具有统计显著性 ( p < 0.05) 的技术(独立)变量对去壳鲜虾副溶血弧菌AEW-HHP 灭活的影响。Beta 系数对应于回归分析估计的标准化系数。Pre和Ti是压力和时间的缩写。
图 2 (A)在实验范围内的额外随机 8 个条件下观察到的虾副溶血弧菌减少量与预测减少量之间的线性相关性。(B)帕累托图,显示具有统计显著性 ( p < 0.05) 的技术(独立)变量对去壳鲜虾副溶血弧菌AEW-HHP 灭活的影响。Beta 系数对应于回归分析估计的标准化系数。Pre和Ti是压力和时间的缩写。
模型建立后,利用Pareto图考察各变量对副溶血性弧菌灭活的相对贡献(图2B)。结果表明,在选定变量内,处理压力是决定AEW-HHP对带壳鲜虾副溶血性弧菌灭活效果的最重要因素,自变量及其交互作用的影响排序为X 2 >X21X12> X 1 = X 3 >X23X32根据图2B。
AEW-HHP对人工污染带壳鲜虾的影响
接种并在生物安全柜中干燥约1小时后,带壳鲜虾上的初始微生物种群副溶血弧菌和单核细胞增生李斯特菌分别为7.12和6.94 log 10 CFU / g 。图3显示了在200、300和400 MPa的HHP和AEW-HHP分别作用10分钟后,去壳鲜虾上副溶血弧菌和单核细胞增生李斯特菌的数量减少。AEW-HHP 处理的虾和 HHP 处理的虾的微生物种群之间存在显著差异(p < 0.05)。所有结果表明AEW-HHP对副溶血性弧菌的灭活效果比HHP更有效和单核细胞增生李斯特氏菌,对于 AEW-HHP,在 400 MPa 下最大减少量分别约为 6.08 和 5.71 log 10 CFU/g(图3)。
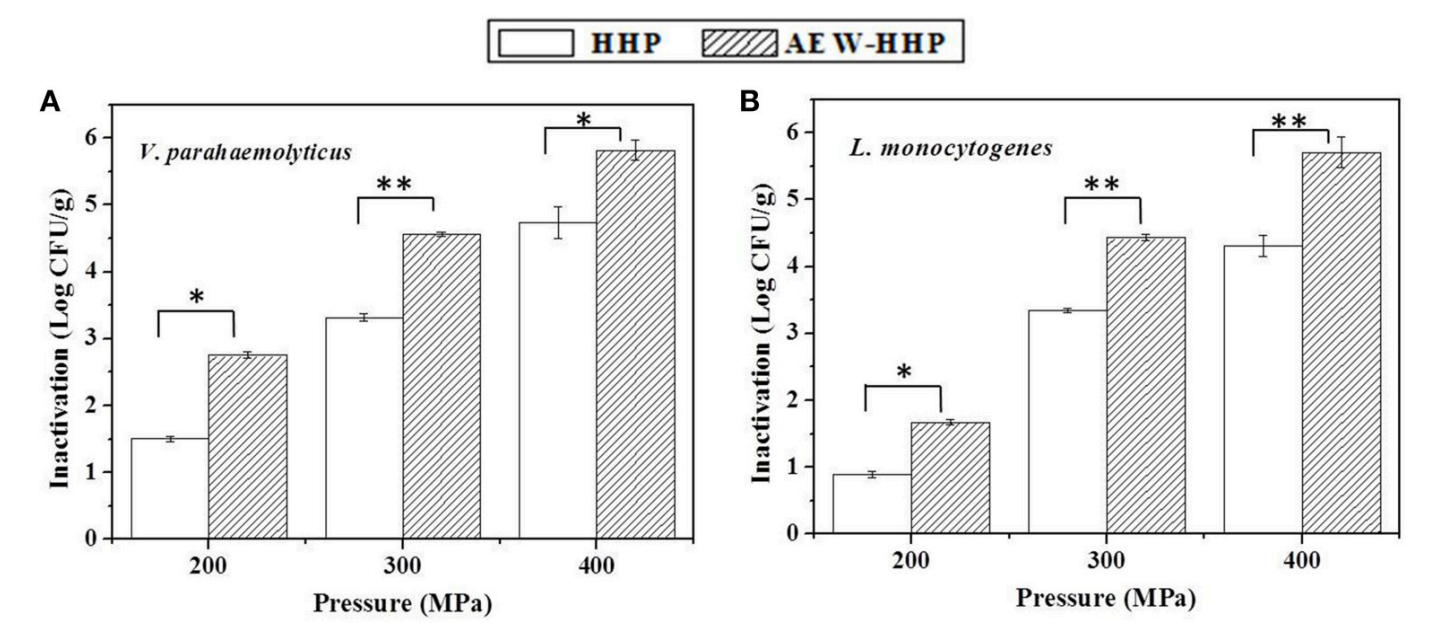 图 3 分别经过 200、300 和 400 MPA 的 HHP 和 AEW-HHP 后,去壳鲜虾上副溶血弧菌(A) 和单核细胞增生李斯特菌( B) 的数量减少。条形代表标准差 ( n = 3)。相同压力内条形上的星号表示显著差异 ( p < 0.05)。
图 3 分别经过 200、300 和 400 MPA 的 HHP 和 AEW-HHP 后,去壳鲜虾上副溶血弧菌(A) 和单核细胞增生李斯特菌( B) 的数量减少。条形代表标准差 ( n = 3)。相同压力内条形上的星号表示显著差异 ( p < 0.05)。
通过SEM观察AEW-HHP对带壳鲜虾细菌微形态的影响,结果如图4所示。如图4所示,作为对照的未经处理的虾样品表面存在大量副溶血性弧菌和单增李斯特菌。经过HHP处理的带壳鲜虾表面仍然存在一些细菌种群(图4),而经过AEW-HHP处理后的虾样品表面几乎没有发现微生物细胞(图4A、B)。因此,这些结果表明AEW-HHP对于减少带壳鲜虾的细菌具有显著的功效。
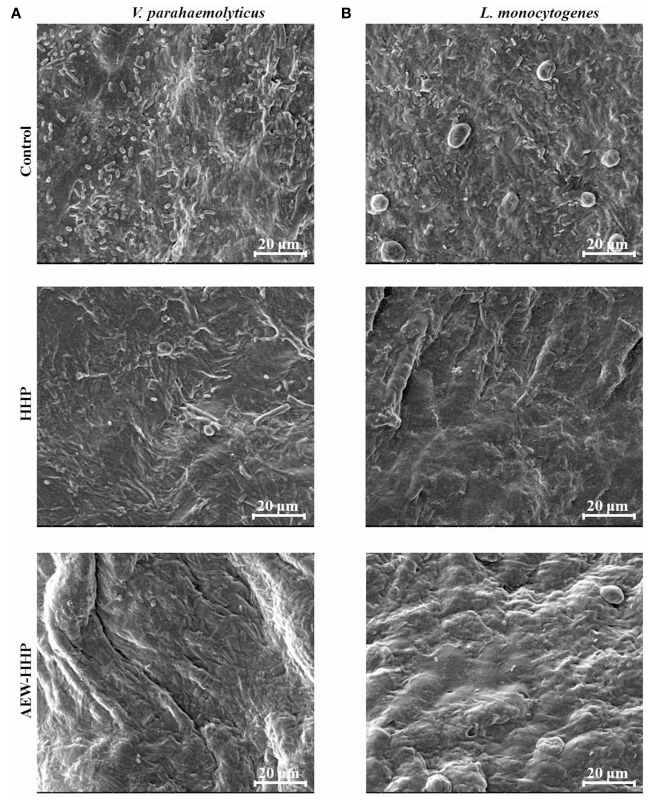
图 4 接种副溶血性弧菌(A) 和单核细胞增生利斯特氏菌(B)的带壳鲜虾经过不同处理后的微生物种群扫描电子显微镜 (SEM) 图。所有处理和测定均一式三份进行。处理如下:未处理为对照;HHP处理(电解氯化钠浓度0 g/L,处理压力400 MPa,处理时间10 min);AEW-HHP处理(电解氯化钠浓度1.5 g/L,处理压力400 MPa,处理时间10 min)。
AEW-HHP 对带壳鲜虾原生微生物区系的影响
图5A报告了AEW-HHP在减少带壳鲜虾上的本地微生物群落方面的功效。未经处理的鲜带壳虾中总需氧菌的初始微生物种群为 6.72 log 10 CFU/g。HHP 处理后,在 200、300 和 400 MPa 下,微生物菌群分别减少了 0.98、3.31 和 4.29 log 10 CFU/g。与HHP相比,AEW-HHP处理的消毒效果明显更好。200、300 和 400 MPa 的 AEW-HHP 可以分别有效减少微生物数量高达 1.47、4.33 和 5.66 log 10 CFU/g。AEW-HHP 处理的虾和 HHP 处理的虾的微生物种群之间存在显著差异(p < 0.05)。
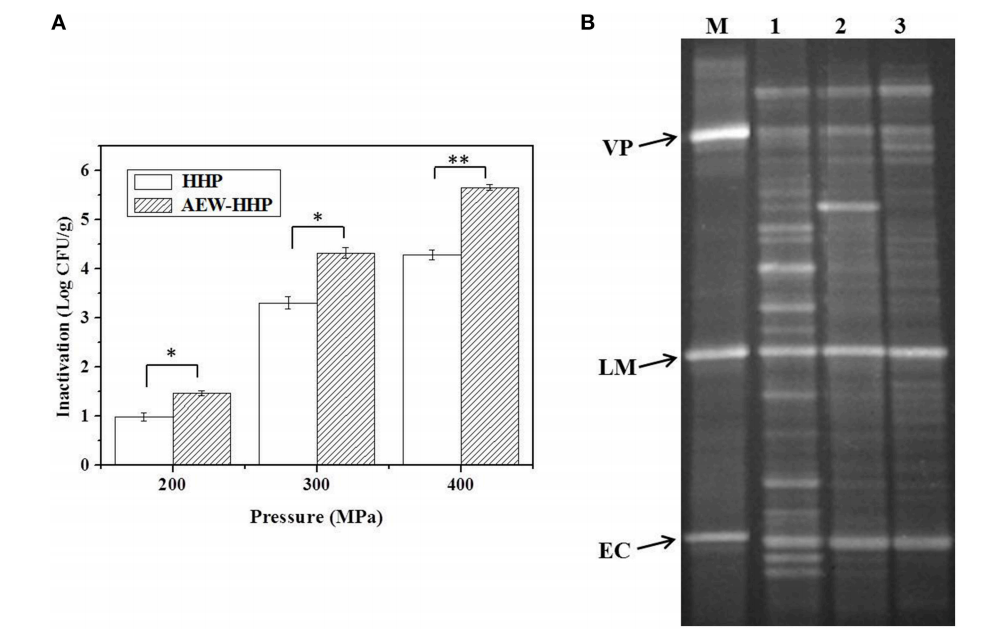
图 5 HHP 和 AEW-HHP 处理后带壳鲜虾的天然微生物菌群数量减少 (A) 和细菌菌群 PCR-DGGE 指纹图谱 (B)。条形代表标准差 ( n = 3)。相同压力内条形上的星号表示显着差异 ( p < 0.05)。M,标记;1、未经处理;2、HHP处理;3、AEW-HHP处理;VP,副溶血弧菌;LM,单核细胞增生利斯特氏菌;EC,大肠杆菌。
采用PCR-DGGE方法研究HHP和AEW-HHP对虾体内微生物群落多样性的影响。PCR-DGGE的结果如图5B所示。DGGE 指纹图谱清楚地表明,HHP 和 AEW-HHP 处理都会降低对虾的细菌多样性,而 AEW-HHP 处理的效果优于 HHP。未经处理的虾样品的香农指数H '为2.883,经HHP处理后该值变为2.418。令人惊讶的是,香农指数H当应用 AEW-HHP 处理虾样品时,' 降低至 2.064。此外,经AEW-HHP处理的微生物群落DGGE指纹的平均相似系数(0.567)低于经HHP处理的微生物群落(0.716)。因此,这些结果直接表明AEW-HHP对降低带壳鲜虾微生物群落多样性具有更强的功效。
AEW-HHP对带壳鲜虾肌纤维的影响
图6显示了经AEW-HHP和HHP处理的去壳鲜虾肌肉纤维的光显微图像。对照组肌纤维紧密附着,肌纤维间隙小得多,其百分比为0.532±0.043。在随后的处理过程中,HHP(图6B)和AEW-HHP(图6C)的空白区域百分比分别为0.478±0.016和0.494±0.022 。根据显微组织学分析,与对照组相比,AEW-HHP处理不仅可以减少带壳鲜虾的自然微生物菌群,而且对虾的肌肉组织没有影响(p > 0.05 )。
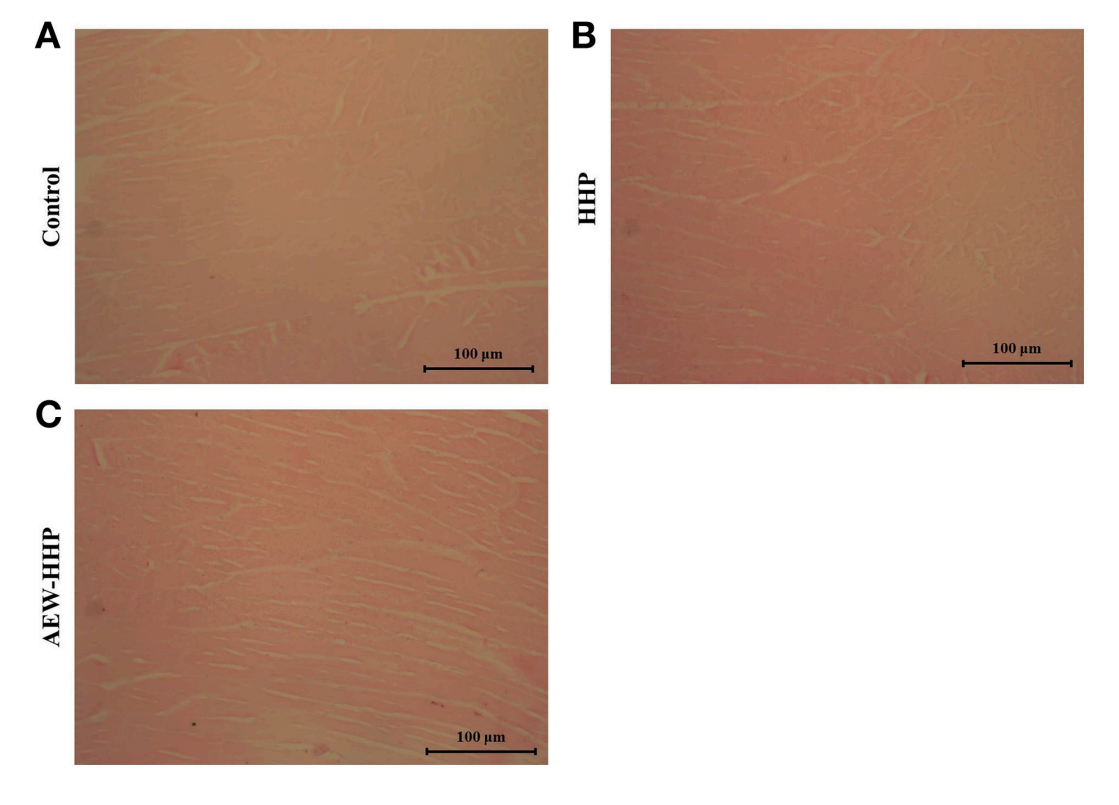
图 6 未处理的对照虾 (A)、HHP 处理的虾 (B) 和 AEW-HHP 处理的虾 (C) 纵向切片的光学显微镜观察。

有效的灭菌和保鲜技术是食品行业食品安全和质量的先决条件。在食品工业的制造过程中,有必要开发一种能够显著诱导微生物灭活并提高加工产品安全性的食品保鲜技术。在本研究中,我们成功地表明AEW可以作为一种新的传播介质来代替普通水,以显著提高HHP对带壳鲜虾的杀菌效果。这种新方法因其优异的性能在食品工业中具有广阔的应用前景。
采用响应面法获得了AEW-HHP灭活带壳鲜虾副溶血弧菌的最佳条件。模型结果表明,1.5 g/L是产生AEW的最佳NaCl浓度,最佳处理压力和处理时间分别为400 MPa和10 min。在优化处理条件下,该方法可有效减少带壳鲜虾上的副溶血弧菌6.08 log 10 CFU/g。本研究开发的响应面模型有力地证明了AEW联合HHP可以有效消除副溶血性弧菌该模型将来还可用于评估副溶血性弧菌感染风险的降低。
为了进一步验证该AEW-HHP方法对其他细菌的灭菌性能,本研究对带壳鲜虾上的单增李斯特菌和本土微生物群落进行了研究。由于副溶血性弧菌灭活的最佳条件可能不适用于其他微生物,因此我们评估了 200、300 和 400 MPa 下虾样品中单核细胞增生李斯特氏菌和本地微生物群落的减少情况(图3、5A )。与普通水作为传压介质相比,AEW-HHP对副溶血性弧菌的灭活效果从4.74 log 10 CFU/g显著提高至6.08 log 10 CFU/g。为了对于单增李斯特氏菌,AEW-HHP可降低5.71 log 10 CFU/g,而HHP仅可降低4.31 log 10 CFU/g。在带壳鲜虾上的本地微生物区系中也观察到了类似的结果,AEW-HHP 显示额外减少了 1.37 log 10 CFU/g。AEW-HHP 的效果明显高于 HHP,这可能是由于杀菌技术之间的协同作用所致。AEW作为一种有效的灭菌剂,不仅被广泛用于消除食品中的多种病原体,而且被证明是改善食品质量的可靠助手。其他干预方法的灭活效率。本研究首次揭示了AEW和HHP之间的协同作用,还需要进一步研究来探讨协同作用的机制。
通过SEM进一步观察虾身上的微生物种群(图4)。SEM已被证明是一种有用的工具,可以为证明治疗后微生物种群的存活或死亡提供直观证据。本研究中,SEM结果与平板计数结果一致;与 HHP 处理相比,经 AEW-HHP 处理的接种副溶血性弧菌和单核细胞增生利斯特氏菌虾样品表面的微生物数量减少。虽然SEM不是定量技术,但它提供了更全面的信息,清楚地显示了AEW-HHP处理后虾上细菌的生存情况。
除了传统方法外,本研究还采用分子技术来评估 AEW-HHP 的效率。DGGE指纹直接证明AEW-HHP比传统HHP在降低虾体微生物群落多样性方面具有更强的功效(图5B)。先前的研究表明,微生物群落与食物腐败有关。减少虾上微生物多样性的能力表明这种新方法可用于防止海鲜腐败。此外,通过显微组织学分析比较了未经处理、HHP 处理和 AEW-HHP 处理的虾样品的肌肉组织。肌肉组织的变化已被证明是食品感官质量的重要指标。结果表明,与未处理组和HHP处理组相比,AEW-HHP处理对虾的肌肉组织没有影响。这表明该方法可以被视为一种新兴的保鲜技术,对食品感官品质的影响有限。
总而言之,本研究的各种结果表明,次氯酸/电解水 可用作新的传输介质,以改善 HHP 加工的灭菌和保存性能。AEW-HHP方法可以作为一种潜在的灭菌保鲜技术,降低微生物感染的风险,确保水产品安全。因此,本研究中开发的 AEW-HHP 方法可以为提高海鲜安全和保护公众健康提供有效的工具。
| 上一个: 没有了 下一个: 【技术专题】用电解机能水生成器消除牙椅水路内的生物膜 |

